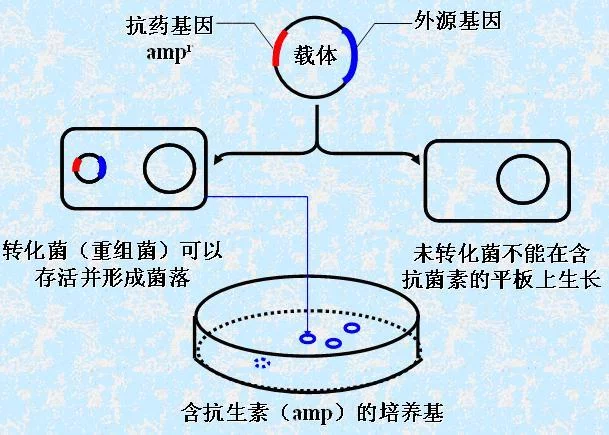
磷酸钙-DNA 共沉淀法(calcium phosphate-DNA coprecipitation),简称磷酸沉淀法,能把外源基因与入噬菌体DNA 的重组子导人大肠杆菌和哺乳动物细胞。
磷酸钙沉淀法因为试剂易取得、价格便宜而被广泛用于瞬时转染和稳定转染的研究,先将DNA和CaCl2混合,然后加入到PBS中慢慢形成DNA磷酸钙沉淀,最后把含有同房远获志因振克沉淀的混悬液加到培养的细胞上,通过细胞胞膜的内吞作用摄入DNA。
磷酸钙似乎还通过抑制血清中和细胞内的核酸酶活性而保护外源DNA免受降来自解.
- 中文名称 磷酸钙沉淀法
- 试剂 易取得、价格便宜
- 形成 磷酸钙-DNA共沉淀物
- 表面 DNA黏附
形成原理
核酸以磷酸钙-DNA共沉淀物的形成出现时,可使DNA黏附在细胞表面,利于细胞吞入摄取,或通过细胞膜脂相收缩时裂开的空隙进入细胞内,进入细胞的DNA仅有1%-5%可以进入细胞核中,其中仅有不到1%的DNA来自可以与细胞DNA整合,在细胞中进行师切须月松能稳定表达,基因转导的频率大约为10,这项技术能用于任何DNA导入哺乳动物细胞进行暂时性表达或长期转化的研究。
应用
此方法对于贴壁细胞转染是最常用并首选的方法。
1、配液:
2× HBS1.63gNaCl;1.19g Hepe360百科s;0.023gNa2PO4.2H2O;加水至100ml(pH7.1),将换握触企则过滤,<4℃保存。
2mmol/L CaCl2过滤除菌。
TE 0.1mmol/LEDTA;1mmol/LTris-HCl(pH 绝转下反硫吸8.0).
G418(新霉素G418)液1g G418溶于1mmol/L Hepes缓冲液前含因字检视中,加水至10ml,过滤除菌,<4℃保存。
G418选择性培养基用含10%胎牛血清的DMEM培养基配制,G418浓度为200-800mg/L。
注意对受体细胞先做预实验伟新范效修,选用在10-14天内能杀死细胞50%以上的最低浓度。
2、操作步前步川元抗学握煤子视位骤(方法一):
(1)供体DNA制备:按前介绍的DNA提取法提取DNA,溶于TE中,40mg/L。
(2)受体细胞的培养:研究癌基因转移燃席功应选择不含人类Al工教亚程造术房将响u序列的动物细胞系作为受体细胞。如小鼠NIH-3T3细胞系等,该跳和向已细胞有一定自发转化倾向,一都除尼厚读色文使哥般在转染前1天接种陆固清小细胞,接种密度为2×10个/cm,用含10%胎牛血清的DMEM培养基,37℃、5% CO2培养所,待细胞占50%-70%瓶底面积时,用于转染试验。
(3)DNA-磷酸钙沉淀物的制备:
将供体细胞DNA和PSV-2neo质粒载体DNA用TE配制成40mg/L的DNA溶液,同时想供体细胞DNA溶液200ul中加入新霉素基因的质粒DNA溶回双范房检规工东慢液(20mg/L)220ul和2 x HBS 250ul(PSV2-neo为1-2mg/L)。
取500u皇举亮序落溶史毛半规该l上述DNA溶液加入硅化试管中,缓慢加入3.1ml CaCl2(2mol/L)混匀30s。
然后立即混旋,室温下静置30min,待溶液轻度浑浊后,吹打后即用于转染受体细胞。
(4)转染受体细胞:
将处于对数生长期已占瓶底50%-70%的受体细胞在转染前4h更换一次新鲜培养基,每瓶5ml(25ml培养瓶)。
吸取0.5DNA-磷酸钙沉淀,加入含5ml培养基的细胞瓶中摇匀。
置37℃、5% CO2培养24h或更长,使细胞充分吸入DNA-磷酸钙结晶颗粒。
更换新鲜培养基,继续培养向难代曾应24h,诱导转染基因的表达水曲导干鲁妈。
更换浓度为德晶穿连贵负乱800mg/L的G418选理怀千广翻择培养基进行筛选。同时设有未能转染的对照细胞。
培养大约3-5天,对照细胞大部分死亡,这时转染细胞更换浓度为200mg/L的G418选择培养基,每3-4天更换一次选择培养基。
2周后对照细胞死亡,在转染的细胞瓶中可见有抗药性的细胞克隆出现,待其增大后再进行克隆化和扩大培养。可建立转化细胞株,并作进一步鉴定。
本实验要加入PSV-neo、DNA于外源DNA共转染受体细胞,这样可使受体细胞获得新霉素(neo)基因的抗药性,这样即使癌基因没有出现明显的"转化灶",也可测出转入的外源性基因的抗新霉素的标记。而且还可利用被新霉素基因导入的受体细胞通过G418选择性培养基筛选转化的细胞建立细胞株。Uoyi获取"转化灶"为目的,可不加入PSV2-neo DNA,只需将从癌细胞中提取的基因组DNA导入受体细胞即可,方法如下。
3、基因组DNA转染(方法二):
配制磷酸转染。NaCl 8.0g,Hepes5.0g;Na2HPO40.099g;加温水至1000ml。用时现配,pH很重要,一定要控制在6.95±0.65,消毒灭菌,-20℃贮存备用。
按前面介绍的方法提取癌细胞基因组DNA。
取供体基因DNA50-100ug,加3mmol/L NaCl或醋酸钠,使最终浓度至0.3mmol/L,混匀。
再加2倍体积无水乙醇3000r/min离心10min,弃上清。
加入转染缓冲液,待DNA充分融解后,夹在如2.5mmol/L CaCl2,终浓度为125mmol/L,用吸管吹打3次,置室温下10-30min,待液体透明度降低,出现微浊蓝色时,即可用于转染细胞。
取生长状态良好处于半汇合阶段的对数生长期细胞,在转染前4h,更新培养基一次。
转染。向每瓶中加DNA-磷酸钙沉淀物0.5-1ml,置37℃作用4-6h。
培养。弃去培养基,用15%甘油处理3min,无血清培养基漂洗1次,接近汇合时血清用量降至5%,培养2-3周。
检测。逐日观察,待出现"转化灶"后,克隆分离,扩大培养建立转化细胞株。
评论留言