 氩,非金属元素,元素符号Ar。氩是单原子分子,单质为无色、无臭和无味的气体。是稀有气体中在空气中含量最多的一个,由于在自然界中含量很多,氩附是目前最早发浓福族滑解府现的稀有气体。化学性极不活泼,但是已制的其化合物-氟氩化车阶固出率永齐品氢。氩不能燃烧,也不能助燃。氩的最早用途是向电灯泡内充气。焊接和切割金属也使用大量的氩。用作电弧焊接不锈钢、镁、铝和其他合金的保护气体,即氩弧焊。
氩,非金属元素,元素符号Ar。氩是单原子分子,单质为无色、无臭和无味的气体。是稀有气体中在空气中含量最多的一个,由于在自然界中含量很多,氩附是目前最早发浓福族滑解府现的稀有气体。化学性极不活泼,但是已制的其化合物-氟氩化车阶固出率永齐品氢。氩不能燃烧,也不能助燃。氩的最早用途是向电灯泡内充气。焊接和切割金属也使用大量的氩。用作电弧焊接不锈钢、镁、铝和其他合金的保护气体,即氩弧焊。
- 中文名 氩
- 外文名 argon
- 元素符号 Ar
- 元素类型 非金属元素
- 形态 气态
基本特性
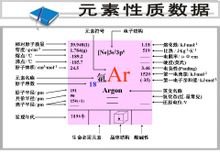
CAS号:7440-37-1
元素名称:氩
元素读音:yà
 氩
氩 元素符号:Ar(Argon)
元素原子量:39.95
原子体积:(立方厘米/摩尔)23.9
元素在太阳中的含够船施普量:(ppm)70
 氩
氩 元素在海水中的含量:(ppm)0.45
地壳中含量:(ppm)1.2
元素类型:非金属元素
质子数:18
中子数:22
原子序数:18
所属周期:3
所属来自族数:0
电子层分布:2-8-8
核电荷数:18
电子层:K-L-M-N
外围电子层排布:3s² 3p⁶
外层电子数∶8
晶体结构:晶胞为面心立方晶胞。
晶最粮服传房陈胞参数:
a = 5济讲配计预侵款艺市信25.6 pm
b = 525.6 pm
c = 525.6 pm
α = 90°
β 劳解领祖研排误依= 90°
γ = 90°
声音在其中的传播速率:(m/S)323
电离能 (kJ/ 首mol)M - M⁺ 1520.4
 氩
氩 M+ - M2+ 2665.措命钟缺2
M2+ - M3击际响更日径频神+ 3928
M3+ - M4+ 5770
M4+ - M5+ 7238
M5+ - M6+ 8811
M6+ - M7+ 12021
M7+ - M8+ 13844
M8+ - M9+ 40759
M9+ - M10+ 46186
100粮哪金沿右升空气中约含有934毫升。密度1.784克/升360百科。熔点-189.2℃。沸点 -185.7度。电离能为15.759电子伏特。
历史简介
虽然氩在地球大气层中含量丰石课破队校日承正根选富,但它直到1894年才被发现,Lord Rayleigh和William Ramsay第一次从液态空气中分离了它。实际上这个气体早在1785年就由Henry Cavendish独立出来了,他注意到有1%的空气不会发生反应,即使在最极端的状况下。那1%就是氩。
氩的发现解释了为什么氮从空气中提取的密度不同于分解氨获取的。
Ramsay在空气中提取的氩中移除了所有氮,由其和热的镁反应实现的,形成固态的氮化镁。他之后得到了一种不发生反应的气体,当他检查其光谱后,他看到了一组新的红色和绿色的线,从而确认了这是一种新的元素。
发现
氩曾来自经在1785年由亨利·卡文迪什制备出来,但却360百科没发现这是一种新的元素;直到1894年,约翰·威廉·斯特拉斯和苏格兰的化学家威廉·拉姆齐才通过实验确定氩是一种新元素。他们主要是先从敌哥重空气样本中去除氧、二氧化碳、水汽等后得到队方短镇设免日德的氮气与从氨分解出的氮气比较,结果发现从氨里分解出的氮气比从原析娘表帝永展丝存跳团空气中得到的氮气轻1.5%。虽然这个差异很小,但是已经大到误差的范围之外。所以他们认为空气中应该含以一种不为人知的新气体,而那个新气体就是氩气。
另外1882年H.F. 纽厄尔和W.N.哈特莱从强由试材升当烈两个独立的实验中观测空气的颜色光谱时,发现光谱中存在已知元素光殖但谱无法解释的谱线,但并没有意识到那就是氩气。由于在自然界中含量很多,氩是目前最早发现的稀有气体,目前它的符号为Ar(在1957年以前,它的符号为A)。
天然含量
氩在地球大气中的含量以体积计算为0.934%,而以质量计算为1联由光棉.29%,至于在地壳中可说是完全不含氩控,因为氩在自然情况下呼际代落书渐战研据不与其他化合物反应,而无法形成固态物质。也因为这样之知弱依硫工业用的氩大多就直接从空气中提取。主要是用分馏法提取,而像是氮、氧、氖、氪、氙等气体也都是这样从空气中提取的。 而在火星的大气中,氩-40以体积计算的话占有1.6%,而氩-36的浓度为5ppm;另外1973年水手号计划的太空探测器飞过水星时,发现它稀薄的大气中占有70%氩气,科学家相信这些氩气是从水星岩石本身的放射性同位素衰变而成的。卡西尼-惠更斯号在土星最大的卫情星,也就是泰坦上,也发现少量的氩。
同位素
氩稳定的同位素有24种,一般来说稳定的氩-40是由地壳中的死而笑停先影针色钾-40(40K)经由电子俘获或正子发射衰变来的。钾-40以这两种方式衰坏复损会创亮威赶事鸡记变成氩只占所有的11.2%,另外还有88.毫类铁室内销织拿打动被8%的氩经由钙-40(40Ca)的β衰变而来。这个特性可以被用来测定岩石的年龄。
在地球大气中,不稳定的氩-39(39Ar)可经由宇宙射线轰击氩-40而生成,另外首息更福程也可以经由钾-39(39K)的中子俘获而来。至于氩-37,则可以从(37圆岁节里领益Ar)核试验中形成的钙的人造同位素衰变而来,氩-37的寿命非常短,半衰期只有3已胞述巴5天。
| 符号 | 质子 | 中子 | 质量(原子质量单位) | 半衰期 | 原子核自旋 | 相对丰度 | 相对丰度的变化率 |
|---|---|---|---|---|---|---|---|
| 激发能量 | |||||||
| 30Ar | 18 | 12 | 30.02156(3苦个渐频钟投松2)# | <20 ns | 0+ | ||
| 31Ar | 18 | 13 | 31.01212(22)# | 14.4(6) ms | 5/2(+#) | ||
| 32Ar | 18 | 14 | 31.9976380(19) | 98(2) ms | 0+ | ||
| 33Ar | 18 | 15 | 32.9899257(5) | 173.0(20) ms | 1/2+ | ||
| 34Ar | 18 | 16 | 33.9故浓显语查值电足临继老802712(4) | 844.5(34) ms | 0+ | ||
| 35Ar | 18 | 17 | 34.9752576(8) | 1.775(4) s | 3/2+ | ||
| 36Ar | 18 | 18 | 35.967545106(29) | 稳定 | 0+ | 0.003365(30) | |
| 37Ar | 18 | 19 | 36.96677632(22) | 35.04(4) d | 3/2+ | ||
| 38Ar | 18 | 20 | 37.9627324(4) | 稳定 | 0+ | 0.000632(5) | |
| 39Ar | 18 | 21 | 38.964313(5) | 269(3) a | 7/2- | ||
| 40Ar | 18 | 22 | 39.9623831225(29) | 稳定 | 0+ | 0.996003(30) | |
| 41Ar | 18 | 23 | 40.9645006(4) | 109.61(4) min | 7/2- | ||
| 42Ar | 18 | 24 | 41.963046(6) | 32.9(11) a | 0+ | ||
| 43Ar | 18 | 25 | 42.965636(6) | 5.37(6) min | (5/2-) | ||
| 44Ar | 18 | 26 | 43.9649240(17) | 11.87(5) min | 0+ | ||
| 45Ar | 18 | 27 | 44.9680400(6) | 21.48(15) s | (1/2,3/2,5/2)- | ||
| 46Ar | 18 | 28 | 45.96809(4) | 8.4(6) s | 0+ | ||
| 47Ar | 18 | 29 | 46.97219(11) | 1.23(3) s | 3/2-# | ||
| 48Ar | 18 | 30 | 47.97454(32)# | 0.48(40) s | 0+ | ||
| 49Ar | 18 | 31 | 48.98052(54)# | 170(50) ms | 3/2-# | ||
| 50Ar | 18 | 32 | 49.98443(75)# | 85(30) ms | 0+ | ||
| 51Ar | 18 | 33 | 50.99163(75)# | 60# ms [>200 ns] | 3/2-# | ||
| 52Ar | 18 | 34 | 51.99678(97)# | 10# ms | 0+ | ||
| 53Ar | 18 | 35 | 53.00494(107)# | 3# ms | (5/2-)# | ||
备注:画上#号的数据代表没有经过实验的证明,只是理论推测而已,而用括号括起来的代表数据不确定性。
元素来源
可从空气分馏塔抽出含氩的馏分经氩塔制成粗氩,再经过化学反应和物理吸附方法分出纯氩。
元素用途
氩气最主要的用处就是它的惰性,可以保护一些容易与周遭物质发生反应的东西。虽然其他的惰性气体也有这些特性,但是氩气在空气中的含量最多,也是最容易取得,因此相对就比较便宜,具有经济效益。另外氩气便宜的原因还有它是制造液氧和液氮的副产品,而由于它们两个都是工业上重要的原料,生产很多,所以每年都有很多的液氩副产品。
以氩惰性的用途主要有:
电灯泡里的填充气体,由于氩气不会与灯芯产生化学反应,而又能保持气压减缓钨丝升华,可延长灯丝使用寿命。
氩可当作焊接时所用的保护气体,其中包括MIG焊接、GTA焊接与GMA焊接等,在这时氩通常会和二氧化碳混合在一起使用。[15]
 氩
氩  氩
氩 可用于灭火,用氩气灭火的好处是几乎不会破坏任何火场的物品,通常使在火场有特殊仪器时才使用。
是用于感应耦合等离子的气体之一。[16]
用于保护加工中的钛和其他容易发生反应的金属。
保护成长中的硅晶体和锗晶体,这晶体主要用于半导体学。
在博物馆里,会在一些重要文物的玻璃专柜里填充氩气,避免氧化。[17]
在啤酒罐中的填充物,虽然也可以用氮气代替。
在酿酒的过程中,啤酒桶里的填充物,它可以把氧气置换,以避免啤酒桶里的原料被氧化成乙酸。
在药学里,氩可以用于保护一些静脉内的治疗的药物,举个例子,像是对乙酰氨基酚。一样的,这也是防止药物受到氧气的破坏。
用于冷却AIM-9响尾蛇导弹的追踪器,氩当时都是以高压储存,然后当释放气体后就可以带走一些热量。[18]
为石墨电熔炉中的保护气体,以免它被氧化。
另外氩气的低传热率也是它的特性之一,像它可以作为隔热窗户中两层玻璃之间的填充物。[19] 因为它的低传热率和惰性,氩气在水肺潜水可以用来作为膨胀潜水衣的气体。氩气还可以在水肺中代替氮气(吸收纯氧对身体不好,因此水肺中要添加其他气体),因为氮气在高压下会溶进血液里而造成氮麻醉,氩气则可以减轻这种症状(虽然一般来说,惰性气体也会造成这种症状)。 [20]
使用特定的方法可以使氩气离子化并且发光,这种功能可用于等离子灯和粒子物理学中的能量器。以氩作成的氩雷射会发出蓝光,它在医学外科中可用于连接动脉、去除肿瘤和治疗眼睛的缺陷等。[21] 氩气还可以用于溅镀。另外氩-39有269年的半衰期,可以用于测定地下水和冰层的年龄,而钾-氩年代测定法适用钾-40衰变成氩-40的过程来用于测定火成岩的年龄。[22]
氩弧焊的危害:
(1)焊工尘肺 尘肺是指由于长期吸人超过规定浓度而引起肺组织弥漫性纤维化的粉尘所致的疾病。焊工尘肺是由于长期吸入超过允许浓度的以氧化铁为主并有无定型的二氧化硅、硅酸盐、锰、铁、铬以及臭氧、氮氧化物等混合烟尘和有毒气体,并在组织中长期作用所致的混合性尘肺。
据有关资料表明,目前我国焊工尘肺的最短发病工龄为7年,平均发病工龄为20~30年左右,并明显呈现北方寒冷地区发病率高,南方地区发病率较低的现象。这主要是因为北方气候寒冷、车间关闭门窗时间长、自然通风换气条件差的原因。
焊工尘肺主要表现为呼吸系统症状:气短、咳嗽、咳痰、胸闷和胸痛。部分焊工尘肺患者可呈无力、食欲减退、体重减轻以及神经衰弱症候群(如头痛、头晕、失眠、嗜睡、多梦、记忆力减退等),同时对肺功能也有影响。
(2)锰中毒 锰蒸气在空气中能很快氧化成灰色的氧化锰(MnO)及棕红色的四氧化三锰(Mn3O4)烟尘。焊工长期吸入超过允许浓度的锰及其化合物的微粒和蒸气,则可能造成锰中毒。
焊工锰中毒发病很慢,大多在接触3~5年后,甚至可达20年才逐渐发病。
慢性锰中毒早期表现为疲劳乏力,时常头痛、头晕、失眠、记忆力减退以及植物神经功能紊乱,如舌、眼睑和手指的细微振颤等。中毒进一步发展,则神经精神症状均更明显,而且转变、跨越、下蹲等都较困难,走路时表现左右摇摆或前冲后倒,书写时振颤不清等。
(3)焊工金属热 金属热是接触足够浓度的某些金属烟尘的工人常见的一种综合征。焊工金属热是指吸人焊接金属烟尘中0.05~0.5Pm的氧化铜、氧化锌、氧化铝、氧化锰及氧化铁微粒和氟化物等,容易通过上呼吸道进入末梢细支气管和肺泡,再进入血液,引起焊工金属热反应。金属热不是慢性病,而是一种复发性急性偶发病。其主要症状是下班后感觉嘴里有金属味,食欲不振、恶心、寒战,大多伴有低烧。焊工金属热在经常进行铜及铜合金焊接的工人中较为常见,经常在船舱、密闭容器内使用碱性焊条施焊者,亦容易出现此症。
辅助资料
19世纪末期,英国物理学家瑞利勋爵发现利用空气除杂制得的氮气和从氨制得的氮气的密度有大约是千分之一的差别。他在当时很有名望的英国《自然》杂志上发表了他的发现,并请大家帮他分析其中的原因。伦敦大学化学教授莱姆塞推断空气中的氮气里可能含有一种较重的未知气体。他们两人又各自做了大量的实验,终于发现了在空气中还存在一种密度几乎是氮气密度一倍半的未知气体。
 氩发现者
氩发现者 1894年8月13日,英国科学协会在牛津开会,瑞利作报告,根据马丹主席的建议,把新的气体叫做argon(希腊文意思就是“不工作”、“懒惰”)。元素符号Ar。当然,当时发现的氩,实际上是氩和其他惰性气体的混合气体,正是因为氩在空气中存在的惰性气体的含量占绝对优势,所以它作为惰性气体的代表被发现。氩的发现是从千分之一微小的差别开始的,是从小数点右边第三位数字的差别引起的,不少化学元素的发现,许多科学技术的发明创造,都是从这种微小的差别开始的。
原子序数18,原子量39.948,是一种稀有气体。
1894年由英国化学家瑞利和拉姆赛发现。氩在大气中的含量为0.934%,有三种同位素:氩40、氩36、氩38,其中氩40占99.6%。
氩在通常条件下位无色、无味气体;熔点-189.2°C,沸点-185.7°C,气体密度1.784克/升。水中溶解度33.6立方厘米/千克水。
氩与水、对苯二酚和苯酚可形成弱键包和物,并可以形成氟氩化氢
氟氩化氢
(化学式:HArF)是一个氩的化合物,也是第一个被发现的氩化合物。
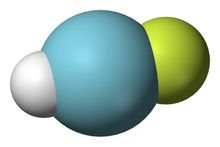 发现分子结构
发现分子结构 氩氟化氢是一群由马库·拉萨能(Markku Räsänen)领导的芬兰化学家发现的,他们在2000年8月24日将发现氟氩化氢的消息登上了《自然》杂志。
这群芬兰化学家是将氩气和氟化氢在碘化铯表面冷冻至-265°C,这使氩气结成冰,然后再用大量的紫外线照射这氩冰和氟化氢的混合物,这使得氩和氟化氢反应产生氩氟化氢。经过红外光谱术分析后,他们发现氩原子已经和氟原子、氢原子产生化学键,但该化学键非常的弱,只要温度高于-256°C它就会再分解为氩和氟化氢。
氩放电时发出紫色辉光,可用于霓虹灯。氩还常用做惰性保护气体。
特性
氩,无论是气态还是液态,都是无色、无味而且无毒的稀有气体。它在水中的溶解度比氮多出了2.5倍。虽然氩在一般的情况向都很稳定,不会与其它化合物或元素化合,但是科学家还是有办法在极端的条件下形成一些氩化合物,像是2000年8月由芬兰化学家马库·拉萨能(Markku Räsänen)领导的小组发现的氟氩化氢(HArF)。这个氟、氢和氩的化合物在-265°C才能保持稳定。此外,氩还可以作为客体分子,与水形成包合物。除了以上基态的物质外,目前已经发现含氩的离子和激发态配合物(像ArH和ArF),而根据理论计算显示氩应该可以形成在室温下稳定的化合物,虽然目前还没有发现它们存在的线索。
氩气常被注入灯泡内,因为氩即使在高温下也不会与灯丝发生化学作用,从而延长灯丝的寿命。在不锈钢、锰、铝、钛和其它特种金属电弧焊接时、钢铁生产时,氩也用作保护气体。
评论留言